Полные антитела - это антитела, которые имеют 2 и более активных центра. После их соединения с антигеном образуется видимый осадок (агглютинат, преципитат).
Неполные антитела - это антитела, которые имеют один активный центр. Они способны связываться с антигенами, но это не сопровождается видимыми изменениями.
Нормальные антитела - это антитела, которые постоянно имеются у человека и животных без попадания в организм антигена (без иммунизации). К ним относятся, например, антитела плазмы крови (агглютинины), которые определяют деление крови человека на 4 группы.
Чтобы защитить организм от этих потенциально опасных аутореактивных В-клеток, все клетки, которые хотят покинуть костный мозг, должны сначала пройти контрольную точку самопроверки. Анализ моноклональных антител показал, что в этой первой контрольной точке большинство, в частности, сильно аутореактивных В-клеток сортируются. Характерной особенностью контроля самодолечения в костном мозге является то, что, с одной стороны, он фильтрует очень эффективные В-клетки, которые распознают антигенные рецепторы, которые неспецифически связываются с структурно различными антигенами и поэтому могут сами по себе не отличаться от других, а также В-клетки, с другой стороны контролируемых, самоаргенты ядра клетки признают.
Лекция№15 Иммунная система организма человека. Антителообразование. Аллергия.
Иммунная система – это система органов и клеток, которые осуществляют защиту от генетически чужеродных агентов (антигенов), в том числе микробных.
Иммунная система состоит из лимфоидной ткани . Основные клетки этой ткани называются лимфоцитами . Общая масса лимфоидной ткани в организме взрослого человека – 1,5 – 2кг, а количество лимфоцитов – 10 13 . Иммунная система включает лимфоидные органы, которые имеют определенную внутреннюю структуру и клетки, которые циркулируют в крови и лимфе.
Сывороточные антитела к самим антигенам клеточного ядра являются характерной особенностью множества аутоиммунных заболеваний. Строгая регуляция, которая отвечает за клетки-реактивные В-клетки в костном мозге, может быть особенно важна для профилактики аутоиммунных заболеваний. Только во второй контрольной точке выделяются дополнительные аутореактивные В-клетки, так что все еще 20% зрелых В-клеток крови, которые готовы участвовать в иммунном ответе, распознают само-антигены. Этот процесс, называемый соматической гипермутацией, имеет место в антиген-активированных В-клетках в зародышевых центрах вторичных лимфатических органов.
Лимфоидные ткани делят на центральные и периферические .
Центральные органы : тимус (вилочковая железа) и костный мозг . У птиц центральный орган – сумка (бурса) Фабрициуса . В центральных органах происходит образование, созревание и "обучение" лимфоцитов, которые после этого (после приобретения иммунной компетентности) поступают в циркуляцию (в кровь и лимфу) и заселяют периферические органы. В тимусе образуются Т-лимфоциты , а в костном мозге и в сумке Фабрициуса – В-лимфоциты .
Случайность, с которой вставлены мутации, не позволяет предсказать, улучшено ли связывание антигена. Только 2% клеток показали низкий уровень аутореактивности. Среди них были, среди прочего, антитела, которые, подобно аутоантителам от пациентов с аутоиммунными заболеваниями, распознавали клеточные ядерные антигены. Наблюдения показывают, что дефекты в контроле таких клеток могут способствовать развитию аутоиммунных заболеваний. Производство моноклональных антител является важной вехой в иммунологии и клеточной биологии.
Когда человеческому телу противостоит чужеродное вещество, например бактерия, специализированные клетки иммунной системы продуцируют антитела против этой бактерии. Бактерия, которая может спровоцировать такой иммунный ответ, затем называется иммуногенной. В ответ на инвазию бактерии стимулируется рост многих различных иммунных клеток, каждый из которых продуцирует различные антитела. Эти различные антитела атакуют на разных участках бактериальной клетки. Полученная смесь антител, образующихся в ответ на иммуногенный агент, называется поликлональной.
Периферические органы: селезенка, лимфатические узлы, небные миндалины, аденоиды, апендикс, пейеровы бляшки кишечника, групповые лимфатические фолликулы мочеполового, дыхательного трактов и др. органов, кровь и лимфа. Клетки этих органов под влиянием антигенов непосредственно осуществляют все реакции клеточного и гуморального иммунитета (образование антител, сенсибилизированных Т-лимфоцитов), поэтому эти клетки называются иммунокомпетентными или иммуноцитами .
Поликлональ, потому что антитела образованы различными вариантами клеток и имеют разные структуры. Такие поликлональные антитела можно использовать довольно много. И последнее, но не менее важное: пассивная вакцинация основана на том факте, что такие поликлональные антитела продуцируются у животных, а затем вводятся пациентам. Однако для исследования у них есть тот недостаток, что нельзя точно определить, где именно индивидуальные антитела сейчас атакуют точно и какие взаимодействия они точно адресуют с их молекулой-мишенью.
Милштейн и Колер, получившие Нобелевскую премию за свои исследования, теперь нашли способ специально производить только один тип антител. Ключевой трюк состоит в том, чтобы сделать восприимчивые иммунные клетки более устойчивыми, чтобы они могли выжить в культуре. Милштейн и Кёлер делали это, сливая иммунные клетки с опухолевыми клетками, которые, как известно, характеризуются безудержным ростом. Такая клетка гибридомы объединяет способность продуцировать очень специфическое антитело с способностью хорошо расти в культуре.
К иммунокомпетентным клеткам относятся 3 вида клеток: макрофаги, Т-лимфоциты и В-лимфоциты.
Эти клетки образуются из общей стволовой клетки костного мозга, которая дает начало предшественнику макрофага и лимфоидной стволовой клетке. Предшественник макрофага затем превращается в макрофаг-моноцит, а лимфоидная стволовая клетка дает начало предшественнику Т-лимфоцитов и предшественнику В-лимфоцитов. Предшественники Т-лимфоцитов мигрируют в тимус, где они "созревают" и образуются все разновидности Т-лимфоцитов. "Созревание" В-лимфоцитов происходит в костном мозге, где они становятся зрелыми костномозговыми В-лимфоцитами. Под влиянием антигена они превращаются в плазматические клетки, которые синтезируют специфические антитела против этих антигенов.
Во-первых, иммунные клетки различной специфичности продуцируются в тестовом быке, главным образом мыши. Эти клетки затем выделяют и сливают с опухолевыми клетками. Затем смесь, которая дает желаемое антитело, выбирают из смеси клеток гибридомы. Это относительно легко, используя целевую молекулу, которая обычно хорошо известна, как крючок. Если выделенная ячейка была выделена, то все клетки, которые позднее продуцируются делением, производят только одно и то же очень специфическое антитело. Это называется моноклональным.
Надежды на использование в качестве высокоспецифичной терапии, которые выполняются как «магические буллиты» целенаправленно и с низким побочным эффектом их работы, были нарушены в первую очередь. Моноклональные антитела мыши не подходят для терапевтического использования человека. Их внешность, к сожалению, заставляет человеческую иммунную систему реагировать, так что желаемый эффект подавляется и могут возникать анафилактические реакции.
На поверхности Т- и В-лимфоцитов находятся различные рецепторы (белковые структуры), которые являются антигенами этих лимфоцитов и по которым различные разновидности лимфоцитов отличаются друг от друга. По этим антигенам можно распознать различные разновидности лимфоцитов, поэтому их называют маркерами или СД-антигенами (международное название).
Чтобы избежать этих недостатков, большие площади мышиных антител, так называемые постоянные области, заменяются соответствующими фрагментами человеческих антител методами генной инженерии. Константные области практически не играют роли для специфичности антител. В зависимости от содержания аминокислотных последовательностей человека, тогда говорят о химеризированных или гуманизированных антителах.
В гуманизированных антителах только небольшие антигенсвязывающие области получают из мышиных антител; общий остаток соответствует белку человеческого антитела. Однако эта процедура часто влечет за собой потерю качества в отношении связывания антитела с его молекулой-мишенью. Таким образом, в так называемых химеризированных антителах включены большие области мышиного антитела. Таким образом, антигенсвязывающие области полностью соответствуют таковым у исходного мышиного антитела. Это улучшает связывание, но может снова привести к проблемам с реакциями отторжения.
По функциям и СД-антигенам лимфоциты разделяют на следующие разновидности или субпопуляции.
Т-хелперы (СД4) – распознают антиген, затем стимулируют образование плазматических клеток и выработку ими антител, активируют макрофаги (участвуют в гуморальном иммунном ответе ).
Т-киллеры или цитотоксические Т-лимфоциты - ЦТЛ (СД8 и СД3 ) – распознают антигены и уничтожают клетки - мишени, несущие антигены, опухолевые клетки, клетки, пораженные вирусами, без участия антител и комплемента при помощи выделяемых ими ферментов-токсинов(лимфотоксинов) (участвуют в клеточном иммунном ответе).
Дальнейшее развитие поэтому нацелено на полное гуманизацию антител. С этой целью были получены трансгенные мыши, в геноме которых весь диапазон, который требуется для образования антител, происходит от людей. Когда эти мыши иммунизируют, они продуцируют «человеческие» антитела. Независимо от того, имеют ли они на самом деле ожидаемые выгоды, должны быть продемонстрированы текущие и будущие клинические испытания. Сегодня также ведутся и другие разумные подходы к созданию больших библиотек человеческих антител.
Например, клонирование соответствующих генов человека может давать очень большие библиотеки в фагах или бактериях, которые затем экспрессируют соответствующий фрагмент антитела на их поверхности. Фрагменты антител, которые специфически связываются с представляющей интерес молекулой-мишенью, теперь обнаруживаются просто путем закрепления ее на твердой основе и добавления всей «библиотеки клонов». Клетки, несущие соответствующий фрагмент антитела на их внешней стороне, связываются с молекулой-мишенью, а остальные клоны могут быть промыты.
Т-супрессоры (СД8) – снижают активность иммунокомпетентных клеток, тем самым, регулируя интенсивность иммунного ответа, участвуют в формировании иммунологической толерантности.
Т-индукторы (СД4) – распознают антиген и увеличивают активность иммунокомпетентных клеток (хелперов, супрессоров, киллеров, макрофагов), регулируя интенсивность иммунного ответа.
Поэтому на матрице остаются только фаги или бактерии, генетический материал которых содержит информацию для искомого фрагмента антитела. Клетки нашей иммунной системы обладают удивительной способностью воспринимать миллиарды молекул и четко различать, является ли она тканью или инородным организмом. Благодаря этой способности наше тело защищает от вирусов и бактерий, и это также является причиной того, что наша иммунная защита отталкивает пересаженные органы и ткани. В случае рака, с другой стороны, наша иммунная система часто терпит неудачу, и поэтому исследователи ищут способы обучения наших защитных клеток распознаванию и борьбе с раком.
Т-эффекторы ГЗТ (гиперчувствительности замедленного типа) (СД8 ) – участвуют в аллергических реакциях замедленного (клеточного) типа, в отличие от ЦТЛ не обладают прямой цитотоксичностью, а разрушают клетки-мишени опосредованно (через другие клетки).
Т-клетки памяти – долго сохраняют "память" об антигене, при повторном попадании в организм этого антигена способствуют более быстрому и сильному иммунному ответу.
Томас Бланкенштейн стал важной вехой на пути к достижению этой цели. Его команда пересадила компоненты иммунной защиты человека в надежде, что сможет использовать антитела против рака у этих животных, чтобы использовать их в качестве новой терапии рака у людей.
Бланкенштейн занимается определенными кровяными кровяными телец, так называемыми Т-клетками, которые играют центральную роль в распознавании телесных молекул. Во время их развития Т-клетки каждый имеют уникальные рецепторы, рецептор Т-клеток. Когда организм вырабатывает новые Т-клетки, мелкие части выбираются из каталога из 170 генов, повторно собраны, а остальные удаляются, как если бы один случайным образом вырезал одно слово из газеты, чтобы перевести его в новый текст. Обычно этого не происходит, потому что тело разрушает Т-клетки с этими рецепторами.
В-лимфоциты – участвуют в образовании антител (гуморальном иммунитете), под влиянием антигена превращаются в плазматические клетки , которые образуют антитела против этого антигена (их маркерами – СД-антигенами - являются эти антитела).
В-клетки памяти – как и Т-клетки памяти.
NK - клетки (естественные киллеры) (их антигены отличаются от Т- и В-лимфоцитов) – "убивают" опухолевые и чужеродные клетки, участвуют в отторжении пересаженных органов, не обладают специфичностью.
Этот механизм защищает нас от аутоиммунных заболеваний, но также предотвращает образование Т-клеток, которые можно использовать для борьбы с опухолями. Вероятно, большинство видов рака вызваны мутациями одного или нескольких белков. Это означает, что они должны содержать уникальный белок, который организм никогда раньше не видел. Многие из этих белков представлены на поверхности опухолевых клеток, где они могут быть обнаружены иммунной системой. Считается, что многие опухоли имеют такие молекулы, так называемые опухолеспецифические антитела.
Нулевые клетки (не имеют антигенов Т- и В-клеток) – незрелые формы лимфоцитов, обладающие цитотоксичностью (способны "убивать"клетки-мишени).
При любой форме иммунного ответа происходит взаимодействие 3-х типов клеток : макрофагов, Т-лимфоцитов и В-лимфоцитов .
Гуморальный иммунный ответ – это выработка иммуноглобулинов (специфических антител). В немучаствуют макрофаги, Т-хелперы и В-лимфоциты .
В поисках методов лечения исследователи, таким образом, концентрируются на опухоле-ассоциированных антителах, потому что это опухоли того же типа у разных пациентов. Т-клетки, которые могут распознать рак, обычно уже разбираются в процессе обучения. «Если бы такие клетки существовали, мы могли бы их добывать, размножать в лаборатории и лечить пациента с ними», - говорит Бланкенштейн. Тогда они смогут вызвать иммунную реакцию, которая атакует опухоль и разрушает ее. Однако, поскольку тело уже экранирует эти Т-клетки раньше, мы не можем «пожинать» их у людей.
Основные стадии гуморального иммунного ответа.
1) поглощение макрофагом антигена (например, микробной клетки), его переваривание, "выставление" на своей поверхности не переваренных частей антигена (они сохраняют чужеродность) для их распознавания Т- и В-лимфоцитами;
2) распознавание антигена Т-хелпером (белковая часть) при непосредственном контакте с макрофагом;
Тем не менее, можно выращивать такие Т-клетки у другого вида. Иммунная система мыши очень похожа на нашу. Т-клетки, которые связываются с белками мыши, но не те, которые распознают ткань человека, сортируются. Теоретически это означает, что такие клетки могут быть сделаны мышью, говорит Бланкенштейн. Переданные пациенту, эти модифицированные клетки могли бороться с опухолью.
Тело признает их чужими и отталкивает их. Перенос такого большого количества генов от людей к мыши затрагивал огромные технические проблемы и требовал нескольких лет работы. Эта работа была успешно завершена рабочей группой, и результаты, по словам Бланкенштейна, скорее всего будут самым большим количеством генов, когда-либо перенесенных с человека на мышь.
3) распознавание антигена В-лимфоцитами (детерминантная часть) при непосредственном контакте с макрофагом;
4) передача неспецифического сигнала активации на В-лимфоцит через медиаторы (вещества): макрофаг вырабатывает интерлейкин-1 (ИЛ-1), который воздействует на Т-хелпер и побуждает его синтезировать и выделять интерлейкин-2 (ИЛ-2), который воздействует на В-лимфоцит;
Теперь исследовательская группа начинает изучать терапевтический потенциал животных. Первой задачей будет выявить связанные с раком молекулы и представить их иммунной защите мышей. В лаборатории клетки снова трансфецируют, и Т-клетки надеются вызвать иммунную реакцию, которая разрушает опухоль.
Такой подход мог бы также помочь Бланкенштейну и его коллегам ответить на открытые вопросы об аутоиммунных заболеваниях. Такие заболевания, вероятно, вызваны ошибками в процессе обучения Т-клеток. Предположительно, несколько Т-клеток, которые проходят через контроль в тимусе, хотя они могут связываться с белками, передающимися через тело, могут стать только проблемой, если что-то пойдет не так. Стратегия, разработанная Томасом Бланкенштейном в лаборатории, могла помочь не только в борьбе с раком, но и против других сложных заболеваний.
5) превращение В-лимфоцита в плазматическую клетку под действием ИЛ-2 и после получения информации от макрофага об антигенной детерминанте;
6) синтез плазматическими клетками специфических антител против попавшего в организм антигена и выделение этих антител в кровь (антитела будут специфически связываться с антигенами и нейтрализовать их действие на организм).
Таким образом, для полноценного гуморального ответа В-клетки должны получить 2 сигнала активации:
1) специфический сигнал – информация об антигенной детерминанте, которую В-клетка получает от макрофага;
2) неспецифический сигнал – интерлейкин-2, который В-клетка получает от Т-хелпера.
Клеточный иммунный ответ лежит в основе противоопухолевого, противовирусного иммунитета и в реакциях отторжения трансплантанта, т.е. трансплантационного иммунитета. В клеточном иммунном ответе участвуют макрофаги, Т-индукторы и ЦТЛ.
Основные стадии клеточного иммунного ответа такие же, как и при гуморальном ответе. Отличие заключается в том, что вместо Т-хелпером участвуют Т-индукторы, а вместо В-лимфоцитов – ЦТЛ. Т-индукторы активируют ЦТЛ при помощи ИЛ-2. Активированные ЦТЛ при повторном попадании антигена в организм "узнают" этот антиген на микробной клетке, связываются с ним и только при тесном контакте с клеткой-мишенью "убивают" эту клетку. ЦТЛ вырабатывает белок перфорин , который образует в оболочке микробной клетки поры (дырки), что ведет к гибели клетки.
Антителообразование в организме человека происходит в несколько стадий.
1. Латентная фаза – происходит распознавание антигена при взаимодействии макрофагов, Т- и В-лимфоцитов и превращение В-лимфоцитов в плазматические клетки, которые начинают синтезировать специфические антитела, но антитела еще не выделяются в кровь.
2. Логарифмическая фаза – антитела выделяются плазматическими клетками в лимфу и кровь и их количество постепенно увеличивается.
3. Стационарная фаза – количество антител достигает максимума.
4. Фаза снижения уровня антител – количество антител постепенно уменьшается.
При первичном иммунном ответе (антиген впервые попадает в организм) латентная фаза длится 3 –5 суток, логарифмическая – 7 – 15 суток, стационарная – 15 – 30 суток, фаза снижения – 1 – 6 мес. и более. При первичном иммунном ответе вначале синтезируются Ig M, а затем Ig G, позже Ig A.
При вторичном иммунном ответе (антиген попадает в организм повторно) длительность фаз изменяется: более короткий латентный период (неск. часов – 1-2 дня), более быстрый подъем антител в крови до более высокого уровня (выше в 3 раза), более медленное снижение уровня антител (в течение нескольких лет). При вторичном иммунном ответе сразу же синтезируются Ig G.
Эти различия между первичным и вторичным иммунным ответом объясняются тем, что после первичного иммунного ответа образуются В- и Т-клетки памяти о данном антигене. Клетки-памяти вырабатывают рецепторы к этому антигену, поэтому сохраняют способность реагировать на данный антиген. При его повторном попадании в организм более активно и быстро формируется иммунный ответ.
Аллергия – это повышенная чувствительность (гиперчувствительность) к антигенам-аллергенам. При их повторном попадании в организм происходит повреждение собственных тканей, в основе которого лежат иммунные реакции. Антигены, которые вызывают аллергические реакции, называются аллергенами. Различают экзоаллергены , попадающие в организм из внешней среды, и эндоаллергены , образующие внутри организма. Экзоаллергены бывают инфекционного и неинфекционного происхождения. Экзоаллергены инфекционного происхождения – это аллергены микроорганизмов, среди них самыми сильными аллергенами являются аллергены грибов, бактерий, вирусов. Среди неинфекционных аллергенов различают бытовые, эпидермальные (волосы, перхоть,шерсть), лекарственные (пенициллин и др. антибиотики), промышленные (формалин,бензол), пищевые, растительные (пыльца). Эндоаллергены образуются при каких-либо воздействиях на организм в клетках самого организма.
Аллергические реакции бывают 2-х видов:
-гиперчувствительность немедленного типа (ГНТ);
-гиперчувствительность замедленного типа (ГЗТ).
Реакции ГНТ появляются через 20-30 мин после повторного попадания аллергена. Реакции ГЗТ появляются через 6 – 8 часов и позже. Различны механизмы ГНТ и ГЗТ. ГНТ связана с выработкой антител (гуморальный ответ), ГЗТ – с клеточными реакциями (клеточный ответ).
Различают ГНТ 3-х типов: I тип – IgE -опосредованные реакции ; II тип – цитотоксические реакции ; III тип – реакции иммунных комплексов .
Реакции I типа чаще всего вызываются экзоаллергенами и связаны с выработкой IgE. При первичном попадании аллергена в организм, происходит образование IgE, которые обладают цитотропностью и связываются с базофилами и тучными клетками соединительной ткани. Накопление специфичных к данному аллергену антител называется сенсибилизацией. После сенсибилизации (накопления достаточного количества антител) при повторном попадании аллергена, вызвавшего образование этих антител, т.е. IgE, аллерген связывается с IgE, находящимися на поверхности тучных и др. клеток. В результате этого происходит разрушение этих клеток и выделение из них особых веществ - медиаторов (гистамина, серотонина, гепарина). Медиаторы действуют на гладкую мускулатуру кишечника, бронхов, мочевого пузыря (вызывают ее сокращение), кровеносные сосуды (повышают проницаемость стенок) и др. Эти изменения сопровождаются определенными клиническими проявлениями (болезненными состояниями): анафилактический шок, атопические болезни – бронхиальная астма, ринит, дерматит, детская экзема, пищевые и лекарственные аллергии. При анафилактическом шоке наблюдается одышка, удушье, слабость, беспокойство, судороги, непроизвольное мочеиспускание и дефекация.
Для предупреждения анафилактического шока проводят десенсибидизацию для уменьшенияколичества антител в организме. Для этого вводятся малые дозы антигена-аллергена, которые связывают и выводят из циркуляции часть антител. Впервые способ десенсибилизации предложил русский ученый А. Безредка, поэтому он называется способом Безредки. Для этого человеку, который ранее получал антигенный препарат (вакцину, сыворотку, антибиотики), при его повторном введении вначале вводят небольшую дозу (0,01 – 0,1 мл), а через 1 – 1,5 часа – основную дозу.
Реакции II типа вызываются эндоаллергенами и вызваны образованием антител к поверхностным структурам собственных клеток крови и тканей (печени, почек, сердца, мозга). В этих реакциях участвуют IgG, в меньшей степени IgM. Образующиеся антитела связываются с компонентами собственных клеток. В результате образования комплексов антиген-антитело активируется комплемент, что приводит к лизису клеток-мишеней, в данном случае клеток собственного организма. Развиваются аллергические поражения сердца, печени, легких, мозга, кожи и др.
Реакции III типа связаны с длительной циркуляцией в крови иммунных комплексов, т.е. комплексов антиген-антитело. Они вызываются эндо- и экзоаллергенами. В них участвуют IgG и IgM. В норме иммунные комплексы разрушаются фагоцитами. При определенных условиях(например, дефект фагоцитарной системы) иммунные комплексы не разрушаются, накапливаются и длительно циркулируют в крови. Эти комплексы осаждаются на стенках кровеносных сосудов и других органах и тканях. Эти комплексы активируют комплемент, который разрушает стенки сосудов, органы и ткани. В результате развиваются различные заболевания. К ним относятся сывороточная болезнь, ревматоидный артрит, системная красная волчанка, коллагенозы и др.
Сывороточная болезнь возникает при разовом парентеральном введении больших дозсывороточныхи других белковых препаратов через 10 – 15 дней после введения. К этому времени образуются антитела к белкам сывороточного препарата и образуются комплексы антиген-антитело. Сывороточная болезнь проявляется в виде отека кожи и слизистых оболочек, повышения температуры тела, припухания суставов, сыпи, зуда кожи. Профилактика сывороточной болезни проводится по способу Безредке.
Реакции IV типа – гиперчувствительность замедленного типа. В основе этих реакций лежит клеточный иммунный ответ. Они развиваются через 24 – 48 часов. Механизм этих реакций заключается в накоплении (сенсибилизации) специфических Т-хелперов под влиянием антигена. Т-хелперы выделяют ИЛ-2, который активирует макрофаги, и они разрушают антиген-аллерген. Аллергенами являются возбудители некоторых инфекций (туберкулеза, бруцеллеза, туляремии), гаптены и некоторые белки. Реакции IV типа развиваются при туберкулезе, бруцеллезе, туляремии, сибирской язве и др. Клинически они проявляются в виде воспаления в месте введения аллергена при туберкулиновой реакции, в виде замедленной аллергии к белкам и контактной аллергии.
Туберкулиновая реакция возникает через 5-6 часов после внутрикожного введения туберкулина и достигает максимума через 24 – 48 часов. Выражается эта реакция в виде покраснения, припухлости и уплотнения на месте введения туберкулина. Эта реакция используется для диагностики заболевания туберкулезом и называется аллергической пробой . Такие же аллергические пробы с другими аллергенами используются для диагностики таких заболеваний, как бруцеллез, сибирская язва, туляремия и др.
Замедленная аллергия развивается при сенсибилизации малыми дозами белковых антигенов. Реакция возникает через 5 дней и длится 2-3 недели.
Контактная аллергия развивается при действии низкомолекулярных органических и неорганических веществ, которые в организме соединяются с белками. Она возникает при длительном контакте с химическими веществами: фармацевтическими препаратами, красками, косметическими препаратами. Проявляется в виде дерматитов – поражений поверхностных слоев кожи.
Организм человека регулярно подвергается воздействию различных возбудителей и чужеродных клеток, поэтому нуждается в надежной защите. В данном случае его защитниками становятся антитела, они играют важнейшую роль в формировании у человека приобретенного иммунитета.
Что такое антитела (АТ), какая роль отводится им в организме, об этом и многом другом мы попытаемся разобраться в этой публикации.
Что представляют собой АТ
 Антитела в крови – это особые белки-иммуноглобины, которые формируются в организме под влиянием антигена. Они образуются из лимфоцитов вследствие попадания инфекций, чужеродных клеток или вакцинации. Если в организме обнаруживаются вирусы, данные белки их уничтожают, при бактериальной инфекции антитела выступают в роли маркеров и вызывают на помощь более сильную защиту иммунитета.
Антитела в крови – это особые белки-иммуноглобины, которые формируются в организме под влиянием антигена. Они образуются из лимфоцитов вследствие попадания инфекций, чужеродных клеток или вакцинации. Если в организме обнаруживаются вирусы, данные белки их уничтожают, при бактериальной инфекции антитела выступают в роли маркеров и вызывают на помощь более сильную защиту иммунитета.
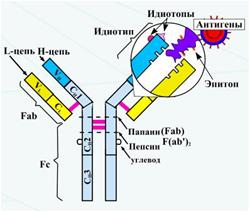
В крови насчитывается более 100 миллионов различного рода антител, в зависимости от того какие инородные клетки попадают на защиту приходят определенные иммуноглобины. Они имеют свойство отличать один антиген от другого и воздействовать только на те, к которым подходят по структуре. Данные белки складываются из четырех основных цепей, две из них легких, а две более тяжелые, также имеют элемент, который их связывает.
Основные виды
Выделяют несколько классов антител:
- IgA – вырабатываются в слюне, молоке и слезах. Эти иммуноглобины способны защищать дыхательные и мочевыводящие пути, а также слизистые оболочки.
- IgE – самый маленький класс, который состоит из 1-2%, данные белки защищают организм при аллергии.
- IgD – класс малоизучен, содержится незначительное количество в крови.
Когда следует проводить обследование на антитела
Как правило, анализ на АТ полагается делать при малейших подозрениях на вирусы и инфекции, а также грибки, глистные инвазии и пр.
Кроме этого, такое обследование помогает контролировать процесс выздоровления при многих патологиях.
 Женщинам, планирующим беременность, следует пройти анализ на антитела к ветрянке и краснухе, поскольку данные болезни очень негативно сказываются на развитии плода. Если у ребенка отсутствуют какие-либо сведенья о прививках, врач может назначить анализ на антитела к дифтерии, полиомиелиту и другим патологиям, для выяснения необходимости назначения вакцинации.
Женщинам, планирующим беременность, следует пройти анализ на антитела к ветрянке и краснухе, поскольку данные болезни очень негативно сказываются на развитии плода. Если у ребенка отсутствуют какие-либо сведенья о прививках, врач может назначить анализ на антитела к дифтерии, полиомиелиту и другим патологиям, для выяснения необходимости назначения вакцинации.
 считаются наиболее важным показателем, который помогает на начальном этапе обнаружить многие аутоиммунные патологии щитовидной железы и сделать прогнозы по поводу функционирования щитовидки. Это один из наиболее чувствительных маркеров к аутоиммунным расстройствам органа.
считаются наиболее важным показателем, который помогает на начальном этапе обнаружить многие аутоиммунные патологии щитовидной железы и сделать прогнозы по поводу функционирования щитовидки. Это один из наиболее чувствительных маркеров к аутоиммунным расстройствам органа.
При бесплодии мужчины, как правило, проходят обследование на антиспермальные АТ. Многим беременным женщинам и тем, кто планирует иметь ребенка, полагается выяснить наличие антител к резус-фактору.
 Хеликобактер виновник воспалительного процесса в желудке и двенадцатиперстной кишке, для его эффективного лечения также проводится обследование на наличие АТ к данной бактерии. О его присутствии в организме свидетельствуют такой класс, как IgA, IGM, IgG.
Хеликобактер виновник воспалительного процесса в желудке и двенадцатиперстной кишке, для его эффективного лечения также проводится обследование на наличие АТ к данной бактерии. О его присутствии в организме свидетельствуют такой класс, как IgA, IGM, IgG.