Cтраница 1
Разложение нитрата аммония каталитически ускоряется также в присутствии соединений хрома. Наиболее реакционноспособ-ными, а потому и особенно опасными металлическими примесями являются кадмий и медь, в присутствии которых образуется неустойчивый, легко разлагающийся нитрит аммония.
Разложение нитрата аммония каталитически ускоряется также в присутствии соединений хрома.
Состав продуктов разложения нитрата аммония зависит от температуры реакции. При низких температурах (около 170 С) она идет по указанному уравнению. При более высоких температурах (выше 250 С) образуются другие продукты (N2, NO и др.), и появляется опасность разложения со взрывом. Однако если нагреть смесь двух солей: KNO3 и (NH4) 2SO4 в эквимолекулярных соотношениях, то при температуре плавления выделяется устойчивая струя N2O, и пропадает необходимость строго следить за температурой опыта. Поэтому для демонстрационного получения закиси азота рекомендуется брать смесь указанных солей.
Состав продуктов разложения нитрата аммония зависит от температуры реакции. При низких температурах (около 170 С) она идет по указанному уравнению. При более высоких температурах (выше 250 С) образуются другие продукты (N2, NO и др.) и появляется опасность разложения со взрывом. Однако если нагреть смесь двух солей: KNO3 и (NH4) 2SO4 в эквимолекулярном соотношении, то при температуре плавления выделяется устойчивая струя N2O, и пропадает необходимость строго следить за температурой опыта. Поэтому для демонстрационного получения оксида азота (I) рекомендуется брать смесь указанных солей.
Во многих работах I1 4 ] указывается на то, что разложение нитрата аммония (НА) подчиняется реакции 1-го порядка.
Нитрит аммония интенсивно и нацело разлагается при 70 - 80 С, разложение нитрата аммония происходит при 230 - 240 С. Низкие температуры процесса обусловливают избирательность взаимодействия NH3 с iNOx и отсутствие необходимости введения дополнительных количеств NH3 на компенсацию его потерь при взаимодействии с кислородом.
Метод позволяет определять 1 - 1000 мг / дм3 ЫН4МОз Метод основан на разложении нитрата аммония щелочью при нагревании, отгонке выделившегося при этом аммиака в раствор серной кислоты, взятой в избытке, и титровании избытка кислоты щелочью в присутствии смешанного индикатора или метилового красного.
Молибденовые остатки выпаривают досуха в фарфоровой чашке на водяной бане и нагревают до 200 С для разложения нитрата аммония. После этого сухой остаток осторожно растирают пестиком и медленно обрабатывают при помешивании избытком раствора аммиака. Прозрачный бесцветный фильтрат подкисляют концентрированной HNO3 до слабокислой реакции. В осадок выпадает молибденовый ангидрид. Осадку дают осесть, декантируют, тщательно отсасывают и промывают малым количеством воды.
Для очистки газа от примесей применяют такую же установку, какая описана при получении закиси азота методом разложения нитрата аммония (см. рис. 69, стр.
Эта реакция является основной, хотя образуются небольшие количества N2 и HNO3, причем азотная кислота в определенных условиях может катализировать разложение нитрата аммония.
Оборудование для жидких азотных удобрений, баки и трубопроводы перед ремонтом должны быть тщательно промыты и продуты , иначе может образоваться воспламеняющаяся смесь воздуха с аммиаком, опасная при сварке и резке металла, так как при высоких температурах может произойти экзотермическая и поэтому взрывоопасная реакция разложения остаточного нитрата аммония. Пролитые растворы нитрата аммония и натрия должны быть немедленно смыты, так как эти соли, как и вообще нитраты, очень опасны в пожарном отношении. При соприкосновении органического вещества, содержащего нитрат, с нагретой поверхностью, например с трубами парового отопления, может произойти мгновенное воспламенение. Деревянные полы, пропитанные нитратом аммония, под действием тепла легко загораются, а кислород, выделяющийся из нитрата, будет усиливать горение.
Наиболее дешевым и изготовляемым в массовых масштабах является нитрат аммония. При разложении нитрата аммония в зависимости от условий, в которых протекает этот процесс, могут получаться различные продукты реакции.
Оксид азота (I) N2O - бесцветный газ со сладковатым запахом, хорошо растворимый в воде. Его получают разложением нитрата аммония.
Азот образует с кислородом несколько окислов. Закись азота N2O представляет собой сладковатый, бесцветный газ; получают ее разложением нитрата аммония при нагревании.
Нитрат аммония NH4NO3, называемый также аммиачной селитрой, получается при насыщении азотной кислоты аммиаком. Эта соль легко плавится и разлагается. Разложение нитрата аммония идет с выделением теплоты, поэтому при сильном нагревании этой соли процесс может принять характер взрыва. Смесь нитрата аммония с сульфатом аммония под названием нитрат-сульфат аммоний применяют в сельском хозяйстве в качестве удобрения. В смеси с такими горючими материалами, как порошок алюминия, мука и измельченный уголь, нитрат аммония образует взрывчатые вещества, называемые аммоналами.
Плодородной земле необходимо удобрение, а в виде эффективной подкормки часто используют нитрат аммония, который официально называется аммиачная селитра. Это азотистое соединение, которое идеально подходит для весеннего использования. Культурные растения получают необходимый для роста азот, однако с такими агрохимикатами тоже не стоит перебарщивать. Аммонийная селитра полезна для цветения в строго оговоренных порциях, поскольку входящая в химический состав сера может высушить корневище, нарушить рост.
Что такое аммиачная селитра
Это химическое соединение активно используется в сельском хозяйстве садоводами. Азотная селитра является универсальным удобрением, одинаково подходит для обработки огорода и сада, выпускается в форме прозрачных гранул или белых кристаллов, не имеет резкого токсического запаха. Химическая формула будет выглядеть так – NH4NO3, она указана на мягкой упаковке стандартной расфасовки.
Состав
Активный компонент селитры аммиачной – азот, который содержит минеральное удобрение концентрацией 26%-34% в зависимости от приобретаемого сорта. Вторым действующим веществом является сера с концентрацией 3-14%. Для весеннего использования это идеальная подкормка, однако важно помнить, что для растительных организмов компонент не самый благоприятный и безопасный. Важно грамотно использовать указанное удобрение, но не перегружать им почвенный состав, иначе он потеряет свои полезные свойства.
Формула нитрата аммония
Указанный агрохимикат востребован в сельском хозяйстве, поэтому химическая формула NH4NO3 на слуху у многих землевладельцев. Такое неорганическое соединение еще называют азотно-кислый аммоний либо нитрат аммония, задействуют для всех видов почвы, в качестве подкормки культурных растений используют по назначению дважды за год – в осенний и весенний период. При сочетании с подзолистым грунтом путем произведения химических реакций появляется кислотность, в остальных случаях такое взаимодействие не обнаружено.
Чем отличается мочевина от аммиачной селитры
Еще одним азотным удобрением является мочевина, которая считается первым конкурентом селитры аммиачной. Оба химических состава отличаются высокой концентрацией азота: в первом случае данный показатель составляет 46%, во втором (для селитры аммиачной) – 35%. Однако это далеко не все отличия этих двух видов подкормки, имеются и другие, не менее существенные при окончательном выборе садовода:
- Мочевину садоводы вносят в прикорневую подкормку и период вегетации растений, тогда как селитру аммиачную – непосредственно в грунт, его глубинные слои.
- Селитра аммиачная меняет химический состав почвы, привлекает заметную кислотность. Поэтому для кислого грунта желательно задействовать мочевину, которая никак не влияет на почвенный состав.
- Мочевина считается органическим (обеспечивает более щадящее действие в почве), а селитра аммиачная – минеральным удобрением неорганического происхождения.
- Селитра аммиачная – взрывчатое вещество, поэтому требует особых условий хранения. Мочевина менее капризная, главное – для сохранности удобрения избегать хранения в местах повышенной влажности.
- Мочевина отличается весьма продолжительным периодом адаптации в грунте, но полученный эффект сохраняется надолго. Селитра сразу начинает работать при соприкосновении с почвой, однако требуется систематическая подпитка.
- Селитра аммиачная способна действовать в холодной, мерзлой почве, тогда как мочевина лучше работает в теплых условиях. При выборе состава важно учитывать климатические условия местности.
Получение аммиачной селитры
Чтобы получить универсальное удобрение, необходимо взять два основных вещества – азотную кислоту концентрированную и аммиак. Формула изотермической реакции выглядит так: NH3+HNO3→NH4NO3+Q, протекает с выделением большого количества тепла. Вода, возникающая в ходе такого взаимодействия, принудительно выпаривается. Это базовый состав. Чтобы получить селитру аммиачную другого сорта, в химический состав основы добавляют кальций, калий, магний. Процесс производства минерального удобрения предельно прост, поэтому приготовить подкормку можно в домашних условиях.
Марки
Широкий ассортимент такой продукции постоянно пополняется, регулярно выпускаются новые марки селитры аммиачной в зависимости от географии применения. Прежде чем покупать и использовать состав селитры, требуется определить вид и качество грунта, учитывать особенности будущего урожая. Только в этом случае каждый квадратный метр земли будет удобрен с умом, окажется плодородным. Учитывая применение селитры, ниже представлены самые распространенные и востребованные марки:
- Аммиачная простая. Самая первая разновидность, основная цель – максимально обеспечить землю азотом. Доступной альтернативой является карбамид (мочевина).
- Аммиачная марка Б. Подходит для массовой подкормки рассады, выращивания цветов на подоконнике, при этом имеет удобную фасовку от 1 кг.
- Аммиачно-калийная. Больше уместна для использования весной с целью питания плодовых деревьев, является подкормкой помидоров, улучшает вкусовые качества многих корнеплодов.
- Известково-аммиачная. Содержит дополнительные вещества – калий, кальций и магний. Имеет форму гранул, отличается длительным периодом хранения, удобной расфасовкой.
- Магний азотнокислый водный. Идеально подходит для бобовых культур, является дополнительным источником магния, повышает питательные свойства грунта.
- Кальциевая. Имеет несколько форм выпуска, продается в сухом и жидком виде, обогащает почву кальцием, уместна при высадке осеннего урожая, подходит для дерновых грунтов.

Применение
Аммонийная соль используется перед или во время посева для удобрения грунта, чтобы культуры, которые будут выращиваться на обработанном участке, дали богатый урожай. Все зависит от состава химиката, марки и особенностей внесения в грунт. Например, легкие почвы удобряют непосредственно перед высадкой, а тяжелые глинистые при уборочных работах после сбора урожая. Качество грунта непосредственно влияет на результат. Важно знать, что подзолистые почвы дают повышенную кислотность при использовании селитры аммиачной.
Селитра как удобрение
Дозировка минерального удобрения зависит от состава грунта, растений, которые в скором времени будут высажены на участке. В данном случае рекомендуется воспользоваться советами опытных садоводов. Например, некоторые овощи (огурцы) и бахчевые культуры (тыква, кабачки) нежелательно удобрять селитрой аммиачной, поскольку плоды собирают и накапливают повышенную концентрацию нитратов. При наличии ботвы и лиственной массы скопление токсинов растению не грозит. Других ограничений нет – состав можно смело использовать как удобрение.
Применение на огороде
Использование такой подкормки напрямую зависит от особенностей и индивидуальных свойств культурных растений. Основная задача садовода – грамотно подобрать удобрение, не испортить урожай, точно (вплоть до грамма) высчитать дозировку, реально оценить все плюсы и минусы своего выбора. Вот ценные рекомендации, если решено использовать химикат на городе:
- Если с одного участка каждый год собирается урожай, например, картофеля, земля теряет часть своих полезных свойств. С каждым годом ее плодородность снижается, поэтому, чтобы защитить урожай, требуется перед очередной посадкой обработать грунт селитрой.
- Указанный состав используют во время перекопки огорода при подготовке почвы к посевной, тогда как при высадке в открытый грунт рассады удобрение задействуют больше как питательную подкормку.
- Овощи положено сначала высадить в грунт, а защищать и удобрять при нехватке питательных веществ при помощи химиката показано лишь спустя неделю. Следующая подкормка уместна лишь за неделю перед цветением.
Нормы внесения
Количество удобрения зависит от качества почвы. Чтобы обогатить питательными веществами окультуренный (здоровый) участок, хватает 20-30 г на квадратный метр, а вот для истощенной земли указанный показатель составляет 35-50 г. Нормы внесения химического состава зависят и от вида культурных растений. Вот ценные рекомендации, которые помогут получить быстрый, здоровый урожай:
- Овощи. На квадратный метр необходимо 5-10 г химиката, внести полагается два раза – в июне перед посадкой и в июле после закрепления плодов.
- Плодовые деревья. Рекомендованная доза – 15-20 г на квадратный метр, подкормку желательно проводить 2-3 раза за лето, под самый корень.
- Корнеплоды. Объем минерального удобрения – 5-7 г, важно обеспечить внекорневую обработку при способности корнеплода масштабно впитывать нитраты.

Совместимость аммиачной селитры
Прежде чем заказать из каталога и купить в интернет-магазине такой полезный для грунта состав, требуется изучить, как ведет себя аммоний азотнокислый с другими химическими элементами. В противном случае можно убить корневую систему растений, не получить запланированный ранее урожай. Совместимость этого минерального удобрения отличается следующими характерными особенностями:
- В комплексе с сульфатом калия, фосфоритной мукой, хлористым калием, натриевой и калиевой селитрой, карбамидом можно продлить срок хранения минерального удобрения.
- В дуэте с суперфосфатами питательные свойства химиката в грунте заметно улучшаются, урожай будет богаче.
- Недопустимые сочетания следующие: с золой, навозом, кальциевой селитрой, удобрениями известковой природы, сухими опилками, сульфатом аммония, торфом, соломой.
Разложение
Процесс разложения минерального удобрения протекает с интенсивной отдачей тепла, может стать произвольным. Чтобы этого не произошло, используются так называемые стабилизаторы. Это вещества, которые связывают азотную кислоту и NO2. Как вариант, стабилизаторами могут быть карбамид, карбонат кальция, хлориды, уротропин и прочие соединения.
Применение аммиачной селитры на даче
Такое химическое соединение имеет массу достоинств, о которых знает каждый садовод. Состав помогает выращивать культурные растения, обеспечивает богатый урожай без вреда для здоровья. При правильном применении агрохимиката на даче содержание нитратов в созревших плодах минимальное, развитие заболеваний организма полностью исключено. Чаще задействуют это минеральное удобрение для подкормки клубники, лука и чеснока, картофеля, огурцов и помидоров.
Условия хранения
Вещество по своему составу является взрывоопасным, поэтому хранить его полагается вдали от солнечных лучей и их прямого попадания. Оптимальное место хранения должно быть сухим, прохладным, при этом важно обеспечить беспрепятственное проникновение свежего воздуха и сквозняков. Допустимая температура окружающей среды – не выше 30 градусов. При завышении температурного режима этот химический состав может произвольно взорваться. Поэтому летом удобрение показано хранить под навесом, при этом выбирать сухие места, а не влажные и сырые помещения.

Цена
Стоимость зависит от многих показателей: от сорта, химического состава, веса упаковки, назначения азотистого соединения. Цены в столице несколько выше, но все равно доступны для покупателей. Прежде чем сделать выбор, рекомендуется проконсультироваться со специалистом, определить состав грунта на собственной даче. Ниже представлены приблизительные расценки по столице:
Видео
Введение
В магазине, разыскивая удобрения для своих цветов и читая их составы, вы наткнулись на незнакомое название - нитрат аммония, который входит в азотную добавку для растений. Большинству людей становится любопытно, ведь они ни разу в жизни не встречали такое вещество. И многие после этого стремятся узнать о нем побольше. Сегодня я удовлетворю ваш интерес.
Определение
Нитрат аммония (формула NH 4 NO 3) является аммонийной солью азотной кислоты. Другие его названия - аммонийная или аммиачная селитра.
Свойства
Имеет вид белого кристаллического вещества. При температуре выше 170 о С нитрат аммония постепенно разлагается. Если же t о условий достигнет отметки 210 о С, то это приведет к полному разложению данного вещества. Нитрат аммония очень хорошо растворяется водой, при повышении температуры последней показатель растворимости увеличивается. Но, так как реакция эндотермическая (проходит с поглощением тепла), то его водные растворы нужно готовить в условиях с высокой температурой.

Также обсуждаемое сейчас соединение растворимо аммиаком, пиридином, этанолом и метиловым спиртом. Будет уместным заметить, что в группе кислых солей веществом, составляющим исключение, является именно нитрат аммония. Гидролиз позволяет это обнаружить, ведь при реакции образуются гидроксид аммония и азотная кислота. При разных температурах разложение данного вещества проходит по-разному, да и продукты каждой из реакций существенно отличаются друг от друга. Например, если температура условий при протекании реакции не достигает отметки 270 о С, то аммиачная селитра распадается на воду и газообразный оксид азота. Если же температура переваливает за пределы 270 о С, то данный нитрат детонирует, и продуктами реакции станут азот, кислород и вода. С ним взаимодействуют растворы щелочей, одним из продуктов данных процессов является аммиак. Тогда говорят, что способом его получения была качественная реакция на нитрат аммония.
Получение
Из-за широкого использования в промышленности люди найчились добывать аммиачную селитру разными способами:
- Взаимодействие безводного аммиака с концентрированной серной кислотой. Реакция экзотермическая, т. е. во время ее протекания выделяется очень много тепла. Поэтому проводить ее в кустарных условиях нежелательно, если не хотите травмироваться. Впрочем, если оба реагента разбавить водой, то аммонийная селитра достаточно легко получается. Тогда образуется расплав, где ее концентрация составляет 83%. Лишнюю воду можно легко выпарить, после этого процентное содержание нитрата аммония составит 95-99,5%. Такой большой промежуток обусловлен разными сортами получившейся аммиачной селитры.
- Способ Габера. Обсуждаемое вещество может быть получено и по методу Габера. Ход реакций можно кратко описать по такой схеме:
водород + азот --> аммиак +кислород --> азотная кислота +аммиак --> нитрат аммония.

Применение
Без использования аммиачной селитры (из-за ее взрывчатых свойств) не обходится горное дело. Также с ее участием проходит изготовление азотных удобрений, в которые, чтобы избежать детонации нитрата аммония, добавляют мел или другие вещества, помогающие его нейтрализовать.
Заключение
Аммонийная селитра может быть как другом, так и врагом для человека, все зависит от цели ее использования. С ней нужно крайне аккуратно обращаться, особенно в условиях с высокой температуры.
осадка CaCO3 получают раствор сульфата аммония, который перерабатывают в готовый продукт выпаркой и кристаллизацией.
Данный процесс может осуществляться и газовым методом с использованием вместо карбоната аммония газообразных аммиака и СО2 по реакции
CaSO4 + 2NH3 + CO2 + H2 O = CaCO3 + (NH4 )2 SO4 .
Однако оба эти метода не нашли промышленного применения из-за низких технико-экономических показателей.
ПРОИЗВОДСТВО НИТРАТА АММОНИЯ
Свойства нитрата аммония. Нитрат аммония NH 4 NO 3 (тех-
ническое название – аммиачная или аммонийная селитра) представляет собой бесцветное кристаллическое вещество с температурой плавления 169,6°С. Он содержит 35% азота в аммонийной и нитратной формах и является безбалластным азотным удобрением. Твердый нитрат аммония в области температур от 169,6°С до –50°С существует в виде пяти полиморфных модификаций, различающихся кристаллической структурой, плотностью кристаллов и объемом кристаллической решетки. Характеристика этих модификаций представлена в табл. 23.
Таблица 23
Кристаллографические характеристики модификаций нитрата аммония
Температурная | Элементарный объем |
||
Модификация | Вид симметрии | кристаллической |
|
существования, °С | решетки, Å3 |
||
Кубическая | |||
Тетрагональная | |||
Ромбическая | |||
Бипирамидальная | |||
(–17)–(–50) | Тетрагональная |
Каждая модификация существует в определенном интервале температур и переход одной модификации в другую сопровождается изменением структуры и объема кристаллической решетки. Эти превращения являются обратимыми и сопровождаются выделением (или поглощением тепла) и скачкообразным изменением удельного объема. При охлаждении расплава аммонийной селитры происхо-
дят последовательные превращения первой модификации во вторую, второй в третью, третей в четвертую и четвертой в пятую.
В точках перехода одной модификации в другую в образовавшихся кристаллах возникают сильные деформационные усилия, которые приводят к их разрушению. Наибольшие деформации испытывают кристаллы NH4 NO3 при последовательном превращении модификаций II → III → IV, так как элементарный объем кристаллической решетки третьей модификации примерно в два раза больше, чем второй, в то время как объемы второй и четвертой модификаций практически одинаковы. Превращение второй модификации в третью происходит при температуре 84,2°С, а третьей в четвертую – при 32,3°С. Во избежание разрушения кристаллов нитрата аммония при охлаждении возникает необходимость заменить последовательные превращения модификаций II → III → IV на метастабильное превращение второй модификации в четвертую, минуя третью. В этом случае деформации кристаллов NH4 NO3 будут минимальными, так как объем кристаллической решетки второй модификации составляет 163,7 Å3 , а четвертой – 155,4 Å3 . Для
решения этой проблемы был выполнен большой объем исследований по определению влияния различных примесей на характер и последовательность модификационных превращений нитрата аммония. Установлено, что характер и последовательность модификационных превращений зависит от содержания влаги в расплаве и примесей сульфата аммония, фосфатов аммония и нитрата магния. Так, при охлаждении плава нитрата аммония, содержащего 0,04– 0,08% Н2 О, происходит замена последовательных превращений модификаций II → III → IV на метастабильный переход II → IV, который осуществляется при температуре 50°С.
Аналогичное влияние на характер и последовательность модификационных превращений нитрата аммония оказывают примеси сульфата аммония, фосфатов аммония и нитрата магния. При содержании этих примесей в расплаве NH4 NO3 0,5–2,0% в процессе охлаждения стабилизируется переход второй модификации в четвертую, минуя третью при температуре 50°С. При наличии этих добавок содержание влаги в расплаве может быть увеличено до 0,2–0,3%.
Это свойство аммонийной селитры широко используется в промышленной практике. При производстве гранулированной аммонийной селитры в состав ее растворов перед выпаркой вводят
соответствующие добавки, выпарку растворов проводят до концентрации 99,7–99,8%, гранулирование расплава осуществляют в грануляционных башнях, а охлаждение гранул – в аппаратах с кипящим слоем до температуры 40–50°С.
Аммонийная селитра хорошо растворима в воде, причем с повышением температуры растворимость резко возрастает. Влияние температуры на растворимость NH4 NO3 характеризуется данными, представленными в табл. 24.
Таблица 24
Влияние температуры на растворимость NH4 NO3 | ||||||||||
Температура, °С | ||||||||||
Концентрация | ||||||||||
NH4 NO3 , % | ||||||||||
Таким образом, при выпарке водные растворы NH4 NO3 могут быть превращены в расплав, что существенно упрощает технологию ее получения за счет исключения стадий кристаллизации из растворов, фильтрации и сушки.
Аммонийная селитра обладает высокой гигроскопичностью, которая характеризуется данными, представленными в табл. 25.
Таблица 25
Зависимость гигроскопичности аммонийной селитры от температуры
Температура, °С | |||||
Гигроскопическая | |||||
При относительной влажности воздуха выше гигроскопической точки аммонийная селитра поглощает влагу из воздуха и увлажняется. При изменении температуры происходит кристаллизация NH4 NO3 из поверхностного раствора, благодаря чему частицы NH4 NO3 сращиваются друг с другом, превращаясь из порошкообразного состояния в монолитную массу. Это явление называется слеживаемостью. Для борьбы со слеживаемостью необходима глубокая сушка продукта, упаковка во влагонепроницаемую тару и обработка поверхности частицантислеживающимигидрофобнымидобавками.
Отрицательными свойствами аммонийной селитры являются низкая термическая устойчивость, пожаро- и взрывоопасность.
Производство азотных удобрений |
При нагревании выше 110°С аммонийная селитра медленно разлагается на аммиак и азотную кислоту по реакции
NH4 NO3 = NH3 + HNO3 + 144,9 кДж.
При 165°С потеря массы селитры не превышает 6 %/сут. При этом аммиак удаляется в газовую фазу, а азотная кислота накапливается в твердой и жидкой фазе и разлагается с выделением NO2 , который вступает во взаимодействие с NH4 NO3 по реакции
NH4 NO3 + 2NO2 = N2 + 2HNO3 + H2 O + 232 кДж.
Эта реакция сильно экзотермична и приводит к образованию новых порций азотной кислоты и к разогреву массы. Таким образом, азотная кислота является катализатором разложения NH4 NO3 , поэтому нельзя допускать ее накопления в массе селитры. При нагревании селитры до температуры 200–270°С протекает слабоэкзотермическая реакция
NH4 NO3 = N2 O + 2H2 O + 36,8 кДж.
При резком повышении температуры, а также под воздействием детонаторов происходит взрывное разложение селитры по уравнению
NH4 NO3 = N2 + 0,5O2 + 2H2 O +118 кДж.
Таким образом, аммонийная селитра является слабым взрывчатым веществом и на ее основе производят взрывчатые вещества – аммониты и аммонолы, представляющие собой смеси селитры с органическими веществами или с порошкообразным алюминием.
Все эти свойства необходимо учитывать при производстве аммонийной селитры, строго соблюдая технологический регламент, и не допускать нарушений правил хранения и транспортировки готового продукта.
Способы получения нитрата аммония. Основным способом получения нитрата аммония является нейтрализация азотной кислоты аммиаком по реакции
HNO3 + NH3 = NH4 NO3 + 144,9 кДж.
Сырьем для получения аммонийной селитры является азотная кислота 47–60%-ной концентрации и аммиак или аммиаксодержащие газы. В результате нейтрализации образуются водные растворы нитрата аммония, которые для получения твердого продукта

подвергаются выпарке. В процессе нейтрализации выделяется большое количество тепла, которое используется для выпарки растворов. Количество выделяющегося тепла зависит от концентрации азотной кислоты. При использовании чистых 100%-ных веществ тепловой эффект реакции составляет 144,9 кДж/моль. При использовании водных растворов азотной кислоты величина теплового эффекта уменьшается на теплоту разбавления 100%-ной азотной кислоты и теплоту растворения аммонийной селитры.
Зависимость теплоты нейтрализации от концентрации азотной кислоты представлена на рис. 38.
q , кДж на 1 моль NH4 NO3
Рис. 38. Зависимость теплоты нейтрализации от концентрации азотной кислоты
С увеличением концентрации азотной кислоты количество выделяющегося тепла на единицу объема раствора возрастает, что позволяет испарять большее количество воды и получать более концентрированные растворы аммонийной селитры.
Зависимость концентрации растворов NH4 NO3 , образующихся в нейтрализаторе при использовании теплоты нейтрализации на выпарку воды, от концентрации HNO3 приведена на рис. 39.
Представленные данные показывают, что при использовании азотной кислоты с концентрацией выше 60% и подогреве исходных реагентов до 100°С и выше количество выделяющегося тепла достаточно для полного испарения воды и получения расплава селитры, что создает предпосылки для организации безупарочного

Производство азотных удобрений |
процесса производства аммонийной селитры. Однако в этих условиях в реакционной зоне развиваются температуры выше 200°С, что приводит к разложению азотной кислоты и селитры, а также к потерям связанного азота. Поэтому безупарочные процессы практически не используются.
CNH 4 NO 3 , %
CHNO 3 , %
Рис. 39. Зависимость концентрации растворов NH4 NO3 от концентрации азотной кислоты:
1 – температура компонентов 70°С;
2 – температура компонентов 20°С; 3 – без использования теплоты реакции
Отвод теплоты нейтрализации из реакционной зоны необходим не только для выпарки раствора, но и с целью предотвращения чрезмерного повышения температуры. Для решения этой проблемы был разработан реактор-нейтрализатор типа ИТН (использователь теплоты нейтрализации), в котором нейтрализация азотной кислоты осуществляется под атмосферным давлением в режиме кипения раствора. Конструкция аппарата ИТН представлена на рис. 40.

HNO3 |
||||
Рис. 40. Аппарат ИТН:
1 – корпус аппарата;2 – реакционный стакан;3 – барботер азотной кислоты;4 – барботер аммиака;
5 – циркуляционные окна;6 – завихритель;
7 – гидрозатвор;8 – сепаратор;
9 – штуцер сокового пара
Аппарат ИТН представляет собой цилиндрический сосуд 1 , в котором установлен реакционный стакан2 . Азотная кислота и аммиак подаются в барботеры3 и4 , расположенные друг над другом. Барботеры обеспечивают встречную подачу реагентов в диспергированном состоянии.
При соприкосновении азотной кислоты с аммиаком происходит мгновенная реакция нейтрализации, сопровождающаяся большим выделением тепла. В результате этого раствор селитры
Производство азотных удобрений |
вскипает, в нем образуются пузырьки пара, создающие большую подъемную силу, под действием которой раствор селитры поднимается вверх и через крышку-завихритель 6 попадает в сепарационное пространство, где происходит отделение сокового пара от раствора. Раствор селитры по зазору между корпусом аппарата и реакционным стаканом опускается вниз и засасывается через отверстия5 внутрь реакционного стакана, благодаря чему осуществляется интенсивная циркуляция раствора. Часть нейтрализованного раствора непрерывно выводится из аппарата ИТН через гидрозатвор7 и сепаратор8 и направляется на выпарку. Соковый пар под давлением 15–20 кПа выводится через штуцеры9 . Разработанный аппарат позволяет осуществлять процесс нейтрализации непрерывно в режиме кипения с максимальным использованием теплоты нейтрализации на выпарку воды, не опасаясь перегрева реакционной массы. С целью уменьшения потерь связанного азота с соковым паром процесс нейтрализации проводят с избытком азотной кислоты (2–3 г/л), так как давление паров HNO3 над раствором NH4 NO3 при ее избытке будет значительно меньше, чем давление паров NH3 при избытке аммиака. При нейтрализации 47– 49%-ной азотной кислоты в аппарате ИТН получают раствор NH4 NO3 с концентрацией 62–65%. При использовании 54–57%-ной HNO3 концентрация раствора NH4 NO3 возрастает до 72–80%, а при концентрации HNO3 58–60% образуется раствор NH4 NO3 c концентрацией 89–92%. При этом температура сокового пара составляет соответственно 120, 130 и 160°С. Это позволяет использовать соковый пар в качестве греющего агента при выпарке раствора NH4 NO3 в вакуум-выпарных аппаратах, благодаря чему достигается двукратное использование теплоты нейтрализации на выпарку воды.
Технологическая схема нейтрализации азотной кислоты с двукратным использованием теплоты нейтрализации представлена на рис. 41. По этой схеме азотная кислота с концентрацией 47– 54% поступает в напорный бак 1 , откуда через автоматический регулятор расхода направляется в аппарат ИТН4 .
Газообразный аммиак под давлением 200–300 кПа проходит сепаратор3 и подогреватель2 для предотвращения попадания в нейтрализатор жидкого аммиака и направляется в аппарат ИТН4 . Расход аммиака автоматически регулируется по величине рН раствора NH4 NO3 на выходе из нейтрализатора так, чтобы

концентрация HNO3 в нейтрализованном растворе составляла 2–3 г/л. Нейтрализованный раствор направляется на выпарку в ва- куум-выпарной аппарат6 , где в качестве греющего агента используется соковый пар. Соковый пар на выходе из аппарата ИТН загрязнен брызгами раствора аммонийной селитры, аммиаком или парами азотной кислоты. Поэтому он подвергается очистке в промывателе5 с тремя ситчатыми тарелками, на которых уложены змеевики, охлаждаемые водой. При этом часть сокового пара конденсируется и на тарелках создается слой конденсата, барботируя через который соковый пар очищается от примесей. После выпарки в вакуум-выпарном аппарате концентрация раствора NH4 NO3 возрастает до 82–92%, после чего он направляется на окончательную выпарку до состояния плава с концентрацией 99,7–99,8%, которая осуществляется свежим паром. Перед окончательной выпаркой раствор NH4 NO3 проходит донейтрализатор7 , где осуществляется полная нейтрализация HNO3 аммиаком и поддерживается избыток аммиака 0,1 г/л, так как на стадии окончательной выпарки наличие свободной азотной кислоты недопустимо.
Соковый пар | |||||
к конденсатору | |||||
HNO3 | |||||
Конденсат |
|||||
Конденсат | |||||
NH4 NO3 на |
|||||
доупаривание |
|||||
NH4 NO3 | |||||
Рис. 41. Схема нейтрализации азотной кислоты
с двукратным использованием теплоты нейтрализации:
1 – напорный бак азотной кислоты; 2 – подогреватель аммиака;3 – сепаратор;4 – аппарат ИТН;5 – промыватель сокового пара;6 – вакуум-выпарной аппарат;7 – донейтрализатор
Производство азотных удобрений |
Описанная схема используется в том случае, если концентрация азотной кислоты не превышает 54%.
В современных схемах производства аммонийной селитры используется азотная кислота с концентрацией 58–60%. При этом
в аппарате ИТН образуется раствор NH 4 NO3 с концентрацией 89– 92%, поэтому использовать соковый пар для окончательной выпарки раствора невозможно, после очистки он выбрасывается в атмосферу. Использовать соковый пар в качестве греющего агента
в других производствах также не представляется возможным, так
как он загрязнен брызгами раствора NH4 NO3 и парами азотной кислоты, что приводит к коррозии оборудования.
При использовании в качестве нейтрализующего агента не 100%-ного аммиака, а аммиаксодержащих газов соковый пар содержит большое количество неконденсирующихся инертных газов, поэтому применение его в качестве греющего агента также невозможно, после очистки от примесей он тоже выбрасывается в атмосферу.
Выпарка растворов аммонийной селитры. Для получения высококачественной аммонийной селитры на стадии выпарки необходимо добиться полного испарения воды так, чтобы остаточное содержание влаги в расплаве не превышало 0,2–0,3%. Эта задача не может быть решена в выпарных аппаратах с восходящей пленкой, так как в них упариваемый раствор и образовавшийся вторичный пар движутся прямотоком в виде парожидкосной смеси, имеющей кольцевую структуру: сплошная жидкая пленка на стенках труб (восходящая пленка), а в центре паровой «стержень», несущий большое количество брызг. По мере движения парожидкосной смеси по высоте труб происходит выравнивание концен-
траций NH4 NO3 в паровой и жидкой фазе, поэтому движущаяся сила процесса уменьшается.
Для полного испарения воды необходимо обеспечить более организованное протекание массобмена при выпарке, что может быть достигнуто в выпарных аппаратах с падающей пленкой и противоточным движением жидкой и паровой фаз.
Для решения этой задачи разработана конструкция комбинированного выпарного аппарата, работающего под атмосферным давлением (рис. 42).
Комбинированный выпарной аппарат состоит из трех частей: очистной I, трубчатой II и концентрационной III.

Паровоздушная смесь
20%-ный раствор | Конденсат |
|||||
NH4 NO3 | ||||||
NH4 NO3 4 | ||||||
NH4 NO3 Пар | ||||||
Конденсат |
||||||
Конденсат
Рис. 42. Комбинированный выпарной аппарат: I – очистная часть; II – трубчатая часть;
III – концентрационная часть; 1 – сетчатый отбойник;2 – штуцер для ввода конденсата;3 – очистные тарелки;4 ,5 – змеевики;6 – ситчатые провальные тарелки
Раствор аммонийной селитры с концентрацией не ниже 87% по обогреваемому коллектору поступает в трубчатую часть выпарного аппарата и стекает вниз по трубкам в виде тонкой пленки. В межтрубное пространство подается водяной пар под давлением 1,4 МПа и с температурой 180–185°С. В трубчатой части концентрация раствора возрастает до 99%. Для окончательного испарения воды плав NH4 NO3 поступает в нижнюю концентрационную
Производство азотных удобрений |
часть аппарата, где установлено пять ситчатых тарелок провального типа. Под нижнюю тарелку вентилятором нагнетается воздух, нагретый в теплообменнике до 185°С. Горячий воздух барботирует через слой расплава на тарелках, захватывает влагу и попадает в трубчатую часть, где поднимается вверх противотоком стекающему раствору.
В концентрационной части образуется плав, содержащий 99,7–99,8% NH4 NO3 , который направляется на гранулирование. Паровоздушная смесь из трубчатой части аппарата содержит большое количество брызг раствора селитры, пары азотной кислоты и аммиак, поэтому она направляется на очистную часть аппарата, в которой установлено две-три ситчатые тарелки. На верхнюю тарелку подается паровой конденсат, а с нижней тарелки отводится раствор NH4 NO3 с концентрацией ~20%, который подается на выпарку. Очищенная паровоздушная смесь выбрасывается в атмосферу. Описанные аппараты имеют производительность от 15 до 60 т/ч, работают стабильно и позволяют получать плав селитры с остаточным содержанием влаги 0,2–0,3%.
Во избежание возникновения аварийных ситуаций при выпарке нельзя допускать повышения температуры в трубчатой и концентрационной частях выше 180°С.
Гранулирование плава аммонийной селитры. В настоящее время все минеральные удобрения выпускаются только в гранулированном виде с размером гранул от 1 до 4 мм. Основным промышленным методом гранулирования аммонийной селитры является разбрызгивание плава NH 4 NO 3 в виде мелких капель навстречу потоку охлаждающего воздуха в грануляционных башнях различной конструкции. Схема процесса гранулирования представлена на рис. 43.
Плав аммонийной селитры, содержащий 99,5–99,7% NH4 NO3 , с температурой 175–180°С из выпарного аппарата поступает в буферный бак1 , фильтруется от механических примесей в фильтрах2 , после чего с помощью коллектора3 направляется в грануляторы4 , установленные в верхней части башни5 и разбрызгивающие плав в виде мелких капель. Башня имеет цилиндрическую или прямоугольную форму и конусное разгрузочное днище. Наибольшее применение получили круглые железобетонные башни диаметром 12–16 м и высотой 30–35 м, а также металлические башни прямоугольного сечения с размером в плане 11×8 м и высотой 50 м.

Через башни с помощью хвостовых вентиляторов просасывается охлаждающий воздух со скоростью 1,5–2,0 м/с.
NH4 NO3 | |
Воздух 3
Рис. 43. Схема процесса гранулирования: 1 – буферный бак;2 – фильтры плава;3 – коллектор-распределитель плава;
4 – грануляторы;5 – грануляционная башня
Основными аппаратами, определяющими форму и размер получаемых гранул, являются грануляторы. В современных схемах производства гранулированной аммонийной селитры используются статические грануляторы леечного и трубчатого типа, конструкция которых представлена на рис. 44.
Принцип действия леечного гранулятора заключается в следующем. Плав из коллектора поступает в гранулятор по патрубку 1 , проходит направляющий конус2 и сетчатый фильтр3 , затем разбрызгивается с помощью перфорированного донышка5 с диаметром отверстий ~1 мм.

Производство азотных удобрений |
А Пар
Конденсат 3 | ||||||
Конденсат | ||||
Рис. 44. Типы статических грануляторов: а – леечный:1 – патрубок для подачи плава;
2 – направляющий конус;3 – корпус гранулятора;4 – сетчатый фильтр;5 – перфорированное днище;б – трубчатый с внешним обогревом:1 – изоляция;2 – корпус гранулятора;3 – обогревающая труба;
в – трубчатый с внутренним обогревом:1 – изоляция;2 – корпус гранулятора;3 – греющая труба;4 – патрубок для подвода пара
Под действием силы тяжести плав вытекает из отверстий в виде струй. Вытекающие струи приобретают волновой характер, амплитуда которого быстро нарастает, и струя распадается на капли диаметром 2–3 мм, которые падают вниз навстречу охлаждающему воздуху. За время полета по высоте башни капли расплава кристаллизуются и охлаждаются до температуры 90–125°С. Окончательное охлаждение гранул до температуры 40–45°С осуществляется воздухом в аппаратах с кипящим слоем, расположенным в нижней части грануляционных башен.
Температура охлаждения гранул в кипящем слое определяется температурой фазового перехода второй кристаллической модификации в четвертую, которая в присутствии кондиционирующих добавок происходит при 50°С.
Для уменьшения слеживаемости охлажденные гранулы подвергаются поверхностной обработке антислеживающими добавками, в качестве которых используются высокомолекулярные органические соединения гетерополярной структуры – органические кислоты и их соли, органические амины с длиной углеводородного радикала С12 –С20 . Механизм действия этих добавок заключается в том, что они адсорбируются на поверхности гранул полярной головкой, а аполярный углеводородный радикал обволакивает поверхность гранул тонкой пленкой и делает ее гидрофобной. Поверхностная обработка гранул осуществляется во вращающихся барабанах путем напыления водных растворов ПАВ на поверхность гранул с помощью форсунок. Расход ПАВ составляет 300– 500 г/т продукта.
Технологическая схема производства аммонийной селитры.
Аппаратурно-технологическое оформление производства аммонийной селитры зависит от концентрации применяемой азотной кислоты. В старых схемах, использующих азотную кислоту с концентрацией 47–49%, нейтрализация кислоты осуществлялась в аппаратах ИТН, а выпарка растворов производилась в три ступени с использованием на первой стадии в качестве греющего агента сокового пара из аппарата ИТН. Схема была весьма громоздкой, а единичная мощность установки составля-
ла 150–250 тыс. т/год.
В 60–70-х гг. XX в. были разработаны и внедрены в промышленную практику крупнотоннажные агрегаты синтеза аммиака и азотной кислоты, позволяющие повысить концентрацию получае-
Производство азотных удобрений |
мой азотной кислоты до 58–60%. Это создало благоприятные предпосылки для разработки крупнотоннажных агрегатов производства аммонийной селитры АС-67 и АС-72 с единичной мощностью 450–500 тыс. т/г. При разработке и внедрении этих агрегатов были учтены последние достижения науки и техники в области повышения качества аммонийной селитры, что позволило выпускать практически неслеживающийся продукт с минимальным загрязнением окружающей среды. В обоих агрегатах в качестве исходного сырья используется азотная кислота с концентрацией 58– 60%, выпарка растворов осуществляется в одну ступень в комбинированных выпарных аппаратах. Для повышения качества продукта предусмотрено введение в его состав кондиционирующих добавок, а для уменьшения загрязнения окружающей среды – глубокая очистка промышленных выбросов. Эти агрегаты отличаются друг от друга только компоновкой оборудования. Наиболее совершенным из них является агрегат АС-72, технологическая схема которого представлена на рис. 45.
Раствор азотной кислоты с концентрацией 58–60% подогревается соковым паром в подогревателе1 до температуры 70–80°С, смешивается с кондиционирующими добавками (серной и фосфорной кислотой) и направляется в аппарат ИТН-72 3 . Газообразный аммиак подогревается в подогревателе2 до температуры 120– 130°С и также направляется в аппарат ИТН, где происходит нейтрализация азотной кислоты при температуре 155–165°С. Образовавшийся раствор нитрата аммония с концентрацией NH4 NO3 89– 92% и концентрацией HNO3 2–5 г/л подвергается донейтрализации аммиаком в донейтрализаторе5 и направляется в комбинированный выпарной аппарат6 , в нижнюю часть которого при помощи воздуходувки27 подается воздух, подогретый в подогревателе4 до 185°С. В комбинированном выпарном аппарате осуществляется полное испарение воды с получением плава селитры, содержащего
99,7–99,8% NH4 NO3 .
Плав нитрата аммония проходит донейтрализатор 7 , фильтры8 и поступает в бак9 , откуда погружным насосом10 перекачивается в напорный бак13 , установленный наверху грануляционной башни18 . Из напорного бака13 плав поступает в три леечных виброгранулятора14 , установленных в верхней части прямоугольной (8×11 м) грануляционной башни18 высотой 50–55 м.

Рис. 45. Схема производства аммиачной селитры в агрегате АС-72:
1 – подогреватель азотной кислоты;2 – подогреватель аммиака;3 – аппарат ИТН;4 – подогреватель воздуха;5 ,7 – донейтрализатор;6 – комбинированный выпарной аппарат;8 – фильтр плава;9 – бак плава;
10 – погружной насос;11 – насос;12 – сборник раствора NH4 NO3 ;13 – напорный бак плава;14 ,15 – грануляторы;16 – хвостовой вентилятор;17 – промывные скрубберы;18 – грануляционная башня;19 – кондиционер гранул;20 – транспортер;21 – элеватор;22 – охладитель гранул;23 – подогреватели воздуха;24 – вентиляторы;
25 – дренажный сборник плава;26 – насос;27 – воздуходувка;28 – буферная емкость
Производство азотных удобрений |
Охлаждающий воздух в количестве 500 тыс. м3 /ч засасывается в башню через зазоры в конической части башни с помощью хвостовых вентиляторов16 и после очитки от пыли в скрубберах17 выбрасывается в атмосферу. За время полета гранулы охлаждаются до 90–120°С. Гранулированный нитрат аммония из грануляционной башни конвейером20 подается в выносной охладитель кипящего слоя22 , состоящий из трех секций с независимой подачей воздуха в каждую секцию с помощью вентиляторов24 . В каждой секции предусмотрено регулирование температуры охлаждающего воздуха с помощью теплообменников23 .
Охлажденные гранулы с помощью элеватора 21 поступают во вращающийся барабан19 , где с помощью форсунок опрыскиваются антислеживающими добавками. Обработанные гранулы нитрата аммония подаются на упаковку.
В агрегате АС-72 установлено два аппарата ИТН-72 производительностью по готовому продукту 30 т/ч каждый. Аппараты состоят из реакционной и сепарационной частей. Диаметр реакционной части составляет 1,6 м; диаметр реакционного стакана – 1,2 м; высота – 4,2 м; диаметр сепарационной части – 3,8 м; общая высота аппарата – 10 м. В сепарационной части установлены четыре колпачковые тарелки и брызгоуловитель. На верхнюю тарелку подается конденсат сокового пара, на вторую снизу – 20–25%-ный кислый раствор NH4 NO3 , образующийся в промывном скруббере17 . В сепарационной части осуществляется очистка сокового пара от аммиака, брызг раствора NH4 NO3 и азотной кислоты. Окончательная очистка сокового пара осуществляется в скрубберах17 , установленных в верхней части грануляционной башни.
Комбинированный выпарной аппарат имеет производительность 60 т/ч. Он состоит из трех частей – трубчатой, концентрационной и сепарационной. Диаметр трубчатой части 2,8 м; высота – 6,4 м, поверхность теплообмена – 710 м2 ; диаметр концентрационной части – 2,8 м; высота – 6 м. В концентрационной части установлено пять ситчатых тарелок, обогреваемых глухим паром. Под нижнюю тарелку нагнетается горячий воздух с температурой 185°С.
Верхняя очистная часть имеет диаметр 3,8 м и высоту 3,5 м. В ней установлены две ситчатые тарелки, которые орошаются па-
ровым конденсатом и раствором NH4 NO3 из скрубберов17 . В сепарационной части происходит предварительная очистка паровоздушной смеси от брызг раствора NH4 NO3 , аммиака и паров азотной кислоты. Окончательная очистка происходит в скрубберах17 совместно с запыленным воздухом, выделяющимся из грануляционных башен. Все технологическое оборудование изготавливается из стали марки 08Х22Н6Т.
Производство аммонийной селитры оказывает минимальное техногенное воздействие на окружающую среду. Твердые и жидкие отходы в этом производстве отсутствуют. Единственным источником загрязнениям окружающей среды являются газообразные отходы – соковый пар из аппаратов ИТН, паровоздушная смесь из комбинированного выпарного аппарата и охлаждающий воздух из грануляционных башен. Они содержат в своем составе брызги раствора NH4 NO3 , пары азотной кислоты, аммиак, пыль и аэрозольные частицы NH4 NO3 . Объем этих отходов весьма велик. Так, количество воздуха, подаваемого в выпарной аппарат, составляет 25 тыс. м3 /ч, в грануляционную башню – 500–550 тыс. м3 /ч.
Поэтому основным способом очистки выхлопных газов является абсорбционный способ, основанный на поглощении вредных примесей водой или слабыми растворами NH4 NO3 . Соковый пар и паровоздушная смесь проходят предварительную очистку в сепарационных частях аппарата ИТН и выпарного аппарата, после чего объединяются с отработанным воздухом, выходящим из грануляционной башни, и направляются в промывные скрубберы17 , которые орошаются паровым конденсатом. Образовавшийся слабый раствор NH4 NO3 собирается в сборниках12 и циркуляционными насосами11 возвращается на орошение скрубберов.
Часть этого раствора подается на орошение в сепарационные части аппарата ИТН и выпарного аппарата, а затем на выпарку. С учетом большого объема отходящих газов в верхней части башни установлено шесть промывных скрубберов, снабженных хвостовыми вентиляторами, которые просасывают воздух через грануляционную башню.
Для более глубокой очистки отходящих газов от аэрозолей в современных схемах дополнительно устанавливаются тонковолокнистые фильтры. После такой очистки отходящие газы выбрасываются в атмосферу.
Скрыть
Физические и химические свойства
Аммиачная селитра (без примесей)
- белое кристаллическое, очень гигроскопичное вещество, на открытом воздухе отсыревает и слеживается. В зависимости от температурных условий, существует пять кристаллических модификаций, способных превращаться друг в друга только при изменении температуры окружающей среды.Практическое значение имеют четвертая и пятая модификации, существующие в следующих пределах:
При переходе из одной модификации в другую происходит перекристаллизация вещества с изменением объема, при этом вещество сильно уплотняется.
Плотность IV модификации - 1,725 г/см 3 .
Аммиачная селитра хорошо растворяется в воде и других веществах:
Аммиачная селитра (удобрение)
- гранулированное вещество с гораздо меньшей гигроскопичностью. Размер гранул - 1-4 мм. Удобрение содержит различные добавки для уменьшения слеживаемости. Конденсирующими веществами могут служить тонкоразмолотая фосфоритная мука, гипс, каолинит, нитрат магния и прочее. Эти добавки придают удобрению желтоватый оттенок. Фиксин, вводимый в качестве добавки, придает ему красноватый цвет.Аммиачная селитра (удобрение) отвечает следующим требованиям:
Аммиачная селитра (удобрение) является окислителем. Пожароопасна. При температуре 210 °C и взаимодействии с серой, серным колчеданом, кислотами, суперфосфатом, хлорной известью и порошковыми металлами разлагается с выделением токсичных окислов азота и кислорода.
Применение
Сельское хозяйство
Аммиачная селитра применяется в качестве удобрения во всех приемах ( , ) и под все сельскохозяйственные культуры.
Выпускаются две марки аммиачной селитры: А - для промышленности и Б - для сельского хозяйства. Допустимо применение марки Б для нужд промышленности.
Марки аммиачной селитры, разрешенные к использованию на территории России, находятся в таблице справа.
Промышленность
В промышленности аммиачная селитра применяется для производства различного рода взрывчатых веществ (аммонитов и гранулитов), а также как реагент для растворения циркониевых оболочек ТВЭЛов при регенерации облученного ядерного топлива.
Поведение в почве
В почве азот из аммиачной селитры легко поглощается микроорганизмами. После минерализации последних азот становится доступным для растений. Одновременно происходит растворение аммиачной селитры в почвенном растворе и вступление в реакцию с почвенно-поглощающим комплексом (ППК).
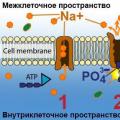
При обменном поглощении аммоний адсорбируется коллоидами почвы, а NO 3 образует соли щелочных или щелочноземельных металлов. (Изображение)
При недостатке кальция на кислых подзолистых почвах внесение аммиачной селитры вызывает некоторое подкисление почвенного раствора. На почвах, богатых основаниями (сероземах и черноземах), даже систематическое внесение высоких доз аммиачной селитры подкисления почвенного раствора не вызывает.
Местное подкисление - явление временное, но может оказать отрицательное влияние на растения в самом начале роста.
Аммонийная часть селитры иногда может подвергаться нитрификации, что также приводит к временному подкислению почвы. Последующая денитрификация приводит к переходу части нитратного азота в газообразное состояние (N 2 , N 2 O, NO).
Применение на различных типах почв
Аммиачная селитра - универсальное удобрение. С некоторыми нюансами она применяется для всех сельскохозяйственных культур и в любой из приемов внесения удобрений.
На кислых почвах
устранить эффект временного подкисления и повысить эффективность аммиачной селитры можно путем известкования или нейтрализации кислотности самого удобрения известью либо доломитом в соотношении 1:1.На кислых дерново-подзолистых почвах
высокий эффект достигается при условии систематического применения нейтрализованной или известково-аммиачной селитры (NH 4 NO 3 + CaCO 3).Черноземы и сероземы
, насыщенные основаниями, не подкисляются. В почвенном растворе таких почв образуется кальциевая или магниевая селитра, что не допускает подкисления и при систематическом внесении значительных доз удобрения. Для таких почв аммиачная селитра - одна из лучших форм азотных удобрений.Влияние на сельскохозяйственные культуры
Внесение аммиачной селитры положительно влияет на все сельскохозяйственные культуры, например, опыты, проведенные в различных штатах США, давали следующие результаты:
Картофель
показывает стабильное повышение урожайности. По сравнению с опытами без азота, урожайность в ц/га при прочих одинаковых условиях увеличивается более чем на 80 ц/га. Пастбищные травы . При достаточном количестве осадков заделка удобрения вразброс дает стойкое увеличение урожайности.Пшеница
. Даже на кислых почвах весеннее внесение аммиачной селитры оказывает положительное влияние на урожайность.Получение
Аммиачная селитра получается нейтрализацией азотной кислоты газообразным аммиаком:
HNO 3 + NH 3 (газ) → NH 4 NO 3 + 144,9 кДж
Полученный раствор нитрата аммония упаривают, подвергают кристаллизации и в конце высушивают. К полученному веществу добавляют различные примеси, улучшающие его физико-химические свойства.